Devenir un laboratoire à gestion allégée
De nombreux laboratoires de cytométrie clinique à travers le monde doivent faire face à la hausse du nombre de tests tandis que le budget et les effectifs restent constants. Il en résulte un besoin continu d'optimiser les flux de travail et d'éliminer le gaspillage.
Afin d'optimiser et de standardiser les flux de travail, les laboratoires doivent identifier les sources courantes de gaspillage au cours de leurs processus et les réduire de manière à libérer du temps pour d'autres tâches productives. Beaucoup de laboratoires pensent être efficaces car ils ont déjà examiné en profondeur leurs opérations et processus auparavant. Cependant, l'efficacité et l'élimination du gaspillage nécessitent des améliorations continues. Il ne s'agit pas d'un événement ponctuel.
Le passage à des pratiques de fabrication allégées au laboratoire clinique montre que même avec le laboratoire le plus efficace, il est toujours possible d'éliminer d'autres types de gaspillages et d'améliorer l'efficacité globale des processus actuels.
Découvrez l'évolution de nos solutions de flux de travail allégé
Les 8 types de gaspillage
Le concept des 8 types de gaspillage trouve son origine dans la gestion allégée de Toyota, une méthode de plus en plus utilisée de nos jours en dehors du domaine initial de la fabrication. L'acronyme couramment utilisé pour les 8 types de gaspillage est DOWNTIME (TEMPS D'INACTIVITÉ) qui correspond à :
- Defects (Défauts) : efforts causés par la retouche, les rebuts et les informations incorrectes.
- Overproduction (Surproduction) : une production supérieure aux besoins ou antérieure à la demande.
- Waiting (Attente) : temps perdu à attendre la prochaine étape d'un processus.
- Not utilizing talent (Non-utilisation des compétences) : sous-utilisation des compétences, qualifications et connaissances des employés.
- Transportation (Transport) : mouvement inutile de produits et de matériaux.
- Inventory excess (Surstockage) : excès de produits et de matériaux traités.
- Motion waste (Mouvements inutiles) : mouvements non nécessaires des employés (marche, par ex).
- Extra processing (Traitements supplémentaires) : quantité de travail ou qualité supérieures aux besoins du client.
Cela permet une approche systématique des flux de travail de révision : Votre stock est-il trop important, vos produits sont-ils défectueux, sont-ils déplacés trop souvent ? En s'appuyant sur cette approche établie et en l'appliquant au cadre du laboratoire clinique, elle peut servir à déceler les manques en matière d'efficacité au cours du flux de travail de cytométrie en flux clinique de routine.
Défauts
Au sein du laboratoire de cytométrie clinique de routine, de nombreux défauts peuvent être attribués à des erreurs humaines. Les zones typiques de défauts sont l'ajout de mauvais réactifs, la préparation de cocktails inappropriée, les erreurs de transcription ou les interversions d'échantillons.
Surproduction
L'une des manières d'accélérer la préparation d'échantillons consiste à préparer des cocktails d'anticorps prémélangés. Cependant, si les futures demandes d'échantillons sont surestimées, une proportion de cocktails de réactifs prémélangés sera mise au rebut avant de pouvoir être utilisée.
Temps d'attente
Il peut arriver que certains processus de votre laboratoire soient externalisés en raison des limites de ressources, ce qui entraîne alors une période d'attente. Domaines clés dans lesquels l'attente fait partie de votre flux de travail de laboratoire actuel :
- Goulots d'étranglement liés au traitement par lots
- Temps de centrifugation et d'incubation
- Temps de traitement des tests envoyés
Non-utilisation des compétences
Il s'agit là d'un type de gaspillage très spécifique, et il est important de ne jamais l'ignorer. Dans cette situation, des employés hautement qualifiés se retrouvent à effectuer des tâches peu qualifiées. De plus, un coût d'opportunité en résulte car l'introduction de nouveaux panels ou l'amélioration des panels existants n'a pas lieu puisque le personnel hautement qualifié doit se charger du pipetage ou de la gestion des stocks.
Transport
Le transport n'est pas seulement un gaspillage du processus mais aussi une menace pour l'environnement. De nombreux laboratoires peinent à gérer leurs stocks car ils doivent souvent jongler avec des dates d'expiration échelonnées pour les réactifs qu'ils se procurent. Il faut prendre en considération le fait que chaque demande de réactif peut nécessiter plusieurs livraisons à température contrôlée. Par ailleurs, le besoin d'externaliser les tests exige également le transport supplémentaire des échantillons.
Gestion des stocks
Les livraisons multiples de réactifs unicolores provenant de différents fournisseurs rendent la gestion des stocks fastidieuse et complexe en raison des variations de qualité et des dates d'expiration échelonnées. Cela peut entraîner la mise au rebut des réactifs et cocktails expirés.
Mouvements
Au sein du laboratoire, il arrive souvent que le personnel quitte la paillasse pour aller vers le réfrigérateur ou la centrifugeuse. Si vous ouvrez et fermez les centrifugeuses ou les réfrigérateurs toute la journée, ces mouvements sont inutiles.
Vous savez que les étapes de pipetage et d'ouverture de vos flacons de réactifs sont trop nombreuses. Si vous procédez au pipetage, ce mouvement n'est pas nécessaire. Si vous devez transcrire, ce mouvement n'est pas nécessaire non plus. Tous ces mouvements requièrent du temps.
Traitements supplémentaires
Les traitements supplémentaires ou les tests répétés sont requis lorsque des erreurs surviennent au cours d'une étape du flux de travail du laboratoire. L'identification et l'élimination des sources d'erreur courantes améliorent le temps de traitement et l'efficacité
Découvrez comment CellMek SPS permet d'éliminer ces gaspillages
Évaluation de votre gaspillage
Observez
La clé pour identifier le gaspillage est l'observation, qui implique une visite du lieu de travail pour voir le flux de travail et la façon dont les employés effectuent leurs tâches. Parler aux employés du flux de travail ou lire un manuel de procédure ne permettra pas d'identifier les zones de gaspillage.
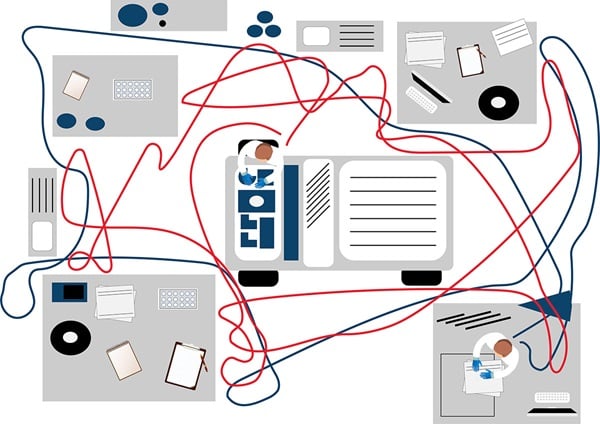
Un outil répandu pour illustrer les flux de travail est le modèle ou diagramme spaghetti, qui montre un plan de salle de fabrication hypothétique avec deux employés (Figure 1a). Le but est de capturer les trajectoires de mouvements, ce qui est effectué en s'asseyant dans le laboratoire et en observant le personnel se déplacer, même s'il s'agit d'un mouvement répété.
Figure 1a. Le modèle spaghetti montre un plan de salle de laboratoire hypothétique et deux employés.
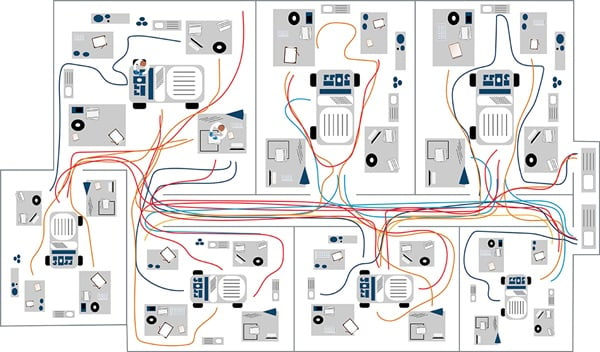
Figure 1b. Exemple de modèle spaghetti de flux de travail de cytométrie clinique.
Dans l'exemple de diagramme spaghetti pour un laboratoire, les couleurs représentent le personnel de laboratoire individuel et ses mouvements respectifs. L'exemple montre que les individus représentés en bleu passent la plupart de leur temps dans une zone. Si vous observez la ligne marron en comparaison, vous pouvez voir que cet individu effectue des déplacements répétés vers une autre pièce, cela représente donc une opportunité pour réduire le mouvement de gaspillage potentiel (Figure 1b). Une autre approche du modèle spaghetti consiste à suivre un échantillon tout au long du flux de travail.
Quantifiez
L'étape suivante qui vous aidera à comprendre votre flux de travail consiste à le quantifier en identifiant des étapes quantifiables :
- Combien de minutes est-ce que cela nécessite ?
- Combien de minutes devons-nous attendre ?
- Combien d'étapes est-ce que cela nécessite ?
- Combien de déplacements sont requis (mesure en nombre de pas ou de carreaux au sol) ?
- Combien d'étapes de pipetage sont requises ?
- Quel est l'état du stock actuel dont nous disposons ?
Cela permet d'établir une ligne de base et de quantifier les améliorations du flux de travail mises en œuvre.
Priorisez
Une fois que les zones de gaspillage ont été identifiées, elles peuvent être priorisées à l'aide de l'analyse Pareto (le classement varie d'un impact élevé à un impact minime). Cela permet d'identifier les zones dans lesquelles l'impact est le plus important qui seront à traiter en priorité. Ce phénomène est aussi connu sous le nom de règle des 80/20 (c'est-à-dire que 80 % des conséquences proviennent de 20 % des causes).
Figure 2. Exemple hypothétique d'un diagramme de Pareto pour un laboratoire de cytométrie en flux clinique.
Le point ou le pourcentage cumulatif dépasse la marque des 80 % indique les zones de gaspillage dont la priorité est faible et qui ne constituent donc pas la priorité actuelle. En fonction des résultats, vous devrez ensuite mettre en place des contre-mesures et les maintenir/suivre selon le facteur ayant été identifié plus tôt comme un élément quantifiable à suivre.
Simplification des flux de travail en cytométrie clinique
Désormais nous allons illustrer cela à l'aide d'un exemple de flux de travail dans un laboratoire de cytométrie clinique qui s'appuie sur le diagramme spaghetti de la Figure 1a.
Pour développer un test, le laboratoire achète plusieurs réactifs unicolores distincts et les combine pour créer un test qui génère les résultats souhaités.
Généralement, les étapes impliquées dans ce flux de travail de test incluent :
1. Contrôle du stock
Vérifiez le stock d'anticorps unicolores et jetez ceux qui ont dépassé la date d'expiration. Les anticorps sont stables pendant une période limitée, et chacun dispose d'une date correspondant à la durée de conservation qui doit être documentée. Si les réactifs doivent être mis au rebut car la date d'expiration a été dépassée, alors des anticorps unicolores supplémentaires doivent être commandés, et le laboratoire doit attendre qu'ils soient livrés. Une fois livrés, les anticorps et leur emplacement, la date d'expiration et le moment où ils ont été ouverts etc., doivent être documentés.
Figure 3. Contrôle du stock de flux de travail.
2. Création d'un panel
Lorsque le moment est venu de commencer le test, le personnel du laboratoire sélectionne les anticorps unicolores dont il a besoin, les sort du réfrigérateur et ouvre tous les couvercles. Ensuite, de nombreux laboratoire pipettent encore leurs réactifs unicolores manuellement.
Dans ce flux de travail, supposons que le laboratoire crée un panel à 10 couleurs (ce qui revient à 10 anticorps par tube, puisqu'il s'agit d'une cytométrie en flux à 10 couleurs). Par exemple, pour créer le panel, quatre tubes sont requis (le nombre total de tubes dépendra du panel réel). Le processus présente de nombreuses sources de gaspillage. Toutefois, à des fins d'illustration, nous nous concentrerons sur le gaspillage lié à la dernière étape du pipetage des anticorps unicolores car il s'agit d'une étape chronophage, manuelle et sujette aux erreurs. Lorsque cette tâche est effectuée manuellement, le mouvement est répétitif car le personnel de laboratoire doit pipeter chaque anticorps individuellement, pour un total de 40 étapes de pipetage, en plus du débouchage et du rebouchage des flacons.
Figure 4. Contrôle du stock de flux de travail et création de panel à 10 couleurs.
3. Exemples de contre-mesures
Au lieu que le personnel de laboratoire pipette tous les réactifs un par un pour chaque échantillon, une contre-mesure potentielle consiste à préparer des cocktails d'anticorps unicolores (Figure 5). Dans cette illustration, nous préparons quatre cocktails différents pour cinq échantillons patient. Cela équivaut à un cocktail pour quatre tubes et cela contribuerait à réduire le nombre d'étapes de pipetage de 200 (40 anticorps multipliés par 5 échantillons) à 60 (4 cocktails contenant 10 anticorps chacun plus la distribution de cocktails pour 5 échantillons). Il en résulte une amélioration significative avec moins de chances d'erreurs et une diminution des mouvements répétitifs.
Cependant, l'ajout de cette étape au flux de travail crée une tâche supplémentaire de préparation des cocktails multicolores d'anticorps unicolores à l'aide de réactifs liquides. Cela nécessite un contrôle qualité (CQ) supplémentaire et, selon la charge de travail, cela peut entraîner la mise au rebut des cocktails arrivés à expiration.
En outre, la préparation de cocktails multicolores à l'aide d'anticorps unicolores ne permet pas d'améliorer la première partie du flux de travail. Le flux de travail lié à la réception des anticorps est fastidieux et n'a pas encore été traité. Une approche alternative consiste à réduire le nombre de tubes pour passer à nouveau de quatre tubes à trois tubes. Cela peut être mis en œuvre en passant d'un cytomètre en flux à 10 couleurs à un cytomètre en flux à 13 couleurs ou en empilant les marqueurs à l'intérieur du panel.
Figure 5. Contrôle du stock de flux de travail et flux de travail de cocktails multicolores pour créer un panel à 10 couleurs.
Parmi les autres méthodes permettant de réduire le gaspillage, on peut citer l'élimination de la dépendance aux réactifs liquides unicolores ou l'installation d'un système de préparation des échantillons automatisé pour étendre les capacités de test du laboratoire, notamment celles qui sont axées sur les tests complexes développés en laboratoire avec des flux de travail mixtes. Mais chaque laboratoire doit choisir l'approche qui répond le mieux à ses besoins.
Résumé
Des flux de travail efficaces sont extrêmement importants dans le laboratoire de cytométrie de routine et plusieurs contre-mesures peuvent être mises en place pour les optimiser.
- Recherchez les mesures les plus faciles à prendre dans le cadre des tests en laboratoire, et élaborez le manuel et les étapes de transcription adaptés. Elles sont toujours associées à des processus nécessitant beaucoup de main d'œuvre et représentent des sources importantes d'erreur.
- Recherchez des moyens de gagner du temps en simplifiant la gestion des stocks et en réduisant le traitement par lots si possible.
- Optimisez votre capacité multiparamétrique pour pouvoir traiter moins de tubes tout en réduisant la charge de travail.
- La diminution du nombre de tubes permet une baisse de la redondance des anticorps ainsi qu'une réduction de l'usage de réactifs.
- Utilisez le concept d'empilage des marqueurs et obtenez même davantage de marqueurs dans un tube, afin d'optimiser la capacité multiparamétrique.