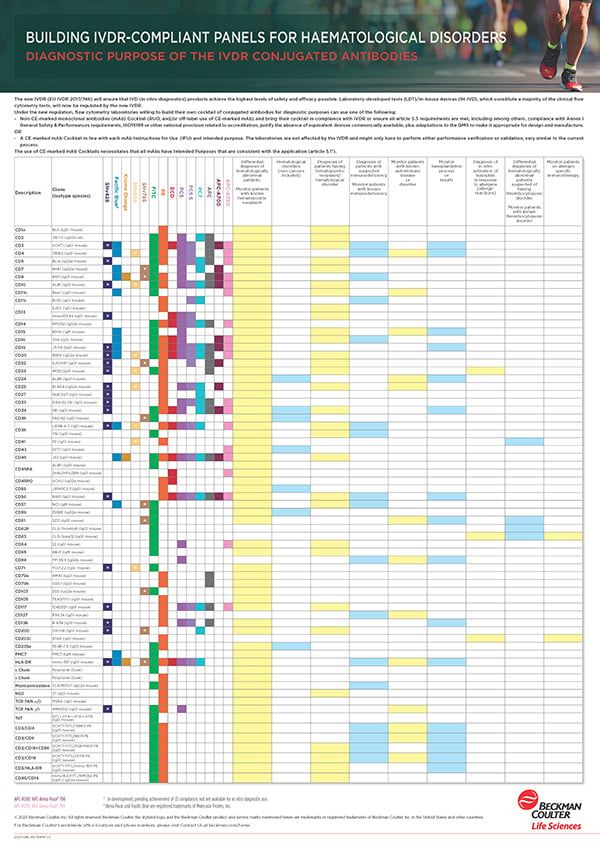
Réglementation sur les DIV (IVDR)

Comme bien d'autres idées visant à améliorer les produits ou les procédures existants, la route du nouveau règlement européen sur les DIV (IVD-R) 2017/746 est pavée de bonnes intentions. Cependant, certaines de ces intentions peuvent potentiellement rendre la vie quotidienne des laboratoires de cytométrie en flux clinique beaucoup plus complexe qu'elle ne l'est actuellement, en raison des dernières réglementations relatives aux tests développés en laboratoire (LDT).
Chez Beckman Coulter Life Sciences, nous nous associons à vous et vous aidons avec le plus grand portefeuille de réactifs conformes aux normes CE-IVD et IVDR sur le marché, et nous vous aidons dans le parcours de vos patients afin d'apporter de la transparence dans ce changement important.
Plus de 250 associés travaillent avec diligence dans le monde entier pour s'assurer que notre portefeuille de produits est prêt pour le nouvel IVDR. En 2023, nous avons agrandi notre solide réseau avec 5 sites de fabrication certifiés afin de répondre à la demande.
Trouvez vos produits IVDR
Introduction aux bases de l'IVDR
Le règlement sur le diagnostic in vitro (RDIV), qui est entré en vigueur en 2017, crée un cadre robuste et transparent de règles qui améliorent la sécurité clinique et réduisent le risque de divergences d'interprétation dans l'ensemble de l'UE. Il introduit des réglementations plus strictes pour les dispositifs médicaux, les tests de laboratoire et les kits de dosage et, pour la première fois, couvre les tests développés en interne par les laboratoires (LDT). Les fabricants et les laboratoires devaient s'y conformer avant mai 2022. Mais la pandémie de COVID-19 a créé un nouveau défi dans le marathon de la mise en conformité pour respecter cette échéance. En conséquence, l'UE a accordé une prolongation du délai de mise en conformité avec l'IVDR.
Révision du calendrier de mise en œuvre des différents aspects de l'IVDR par les laboratoires
Ressources pour aider votre laboratoire à effectuer une transition en douceur vers l'IVDR
Contrairement à la précédente directive sur les DIV, le nouveau règlement s'appliquera aux tests de DIV réalisés en interne par les laboratoires. Cela signifie que les laboratoires doivent respecter des normes qui sont, à bien des égards, similaires à celles des fabricants. Pour commencer, les laboratoires doivent vérifier tous les tests effectués dans le laboratoire et poser des questions telles que :
Les laboratoires qui choisissent de fabriquer des LDT en raison de l'absence d'alternative viable doivent mettre en place un système de gestion de la qualité (SGQ) conforme à la norme ISO-15189 "Laboratoires médicaux - Exigences en matière de qualité et de compétence". Cette norme exige que le laboratoire soit accrédité pour chaque mesure/analyse qu'il effectue. Le contrôle et l'enregistrement des performances des tests, la tenue d'une documentation sur la fabrication et l'utilisation des tests et la justification des raisons pour lesquelles les exigences omises ne sont pas applicables font tous partie du système de gestion de la qualité.
Les livres blancs suivants constituent un point de départ pour configurer votre laboratoire en vue de la création conforme à l'IVDR de tests développés en laboratoire à l'aide de produits RUO ou de produits CE-IVD s'écartant de l'IFU.